Entidade avaliou que os benefícios do Zolgensma são superiores aos seus riscos e pode ser registrado no Brasil
A Anvisa publicou nesta segunda-feira, 17 de agosto, o registro do produto de terapia gênica Zolgensma® (onasemnogeno abeparvoveque), da empresa Novartis Biociências S.A. O medicamento é usado para o tratamento da atrofia muscular espinhal (AME), uma doença rara e grave, causada pela alteração do gene que codifica a proteína SMN (survival motor neuron), molécula necessária para a sobrevivência do neurônio motor, responsável pelo controle do movimento muscular.
A AME causa fraqueza, hipotonia, atrofia e paralisia muscular progressiva e possui incidência mundial aproximada de 1:10.000 nascidos vivos, dos quais cerca de 45% a 60% dos casos são AME do tipo 1, forma mais grave da doença, sendo a principal causa de mortalidade infantil decorrente de uma doença monogenética.
O Zolgensma obteve o registro na Anvisa para o tratamento de pacientes pediátricos diagnosticados com AME do tipo 1, com até dois anos de idade, com mutações bialélicas no gene de SMN1 ou até três cópias de outro gene conhecido como SMN2.
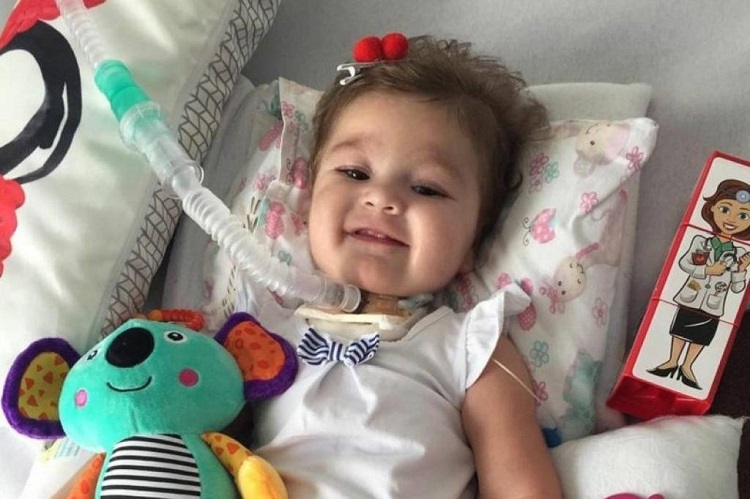
O medicamento foi utilizado na menina Antonella Garcia Cunha Moro, hoje com dois anos, que recebeu a dose no último dia 13 de fevereiro, no University Hospital Rainbow Babies & Children’s, unidade de saúde de Cleveland, estado de Ohio. Os pais da menina iniciaram uma campanha para arrecadar cerca de R$ 9 milhões, para os custos do tratamento. Depois de seis meses, a evolução no quadro clínica da menina é notório.
Engenharia genética
Desenvolvido por engenharia genética, é um produto de terapia avançada, do tipo terapia gênica, composto por um vetor viral que carrega uma cópia funcional do gene humano responsável pela produção da proteína SMN, capaz de restaurar a função do neurônio motor no organismo dos pacientes.
Os estudos realizados até o momento com o Zolgensma demonstraram que uma aplicação única do produto pode melhorar a sobrevivência dos pacientes, reduzir a necessidade de ventilação permanente para respirar e alcançar marcos de desenvolvimento motores. Os efeitos colaterais do produto são considerados controláveis, sendo que o mais comum observado nos estudos foi o aumento das enzimas hepáticas, resolvido após tratamento com corticosteroides.
A Anvisa avaliou, portanto, que os benefícios do Zolgensma são superiores aos seus riscos e pode ser registrado no Brasil. No entanto, por ser uma terapia gênica inovadora, foi aprovado um registro de caráter excepcional. Isso significa que estudos adicionais devem ser realizados pela empresa para a confirmação de sua eficácia e segurança em longo prazo.
Termo de compromisso
Nesse sentido, foi assinado um Termo de Compromisso em que a Novartis se responsabiliza por enviar anualmente dados dos estudos em andamento à Anvisa e ainda assegurar a realização de estudos complementares de acompanhamento de pacientes brasileiros, de forma a acompanhar o perfil de segurança e de eficácia do produto no país em longo prazo, na perspectiva da avaliação da manutenção do balanço benefício x risco positivo, como atestado no registro.
As informações técnicas sobre o Zolgensma e as condições impostas ao detentor de registro no Termo de Compromisso serão informadas publicamente, junto com prazos e datas para sua execução, por meio do portal da Agência.
Prazo
Foram 149 dias úteis de avaliação, desde a submissão dos documentos pela Novartis à Anvisa até a publicação do deferimento final no Diário Oficial da União, considerando os prazos de análise da equipe da Agência (117 dias) e das respostas ao cumprimento das exigências por parte da empresa (32 dias). Para garantir a efetiva regularização do Zolgensma no Brasil, houve inúmeras reuniões, discussões técnicas e acordos entre a Anvisa e representantes nacionais e internacionais.
Com a publicação do registro a Agência cumpre a legislação nacional, que prevê um prazo de análise pela instituição de 120 dias para produtos priorizados.
Fonte: Jornal de Pomerode

Sugestão de pauta